Le graphite, formule moléculaire : C, poids moléculaire : 12,01, est une forme d'élément carbone, chaque atome de carbone est relié par trois autres atomes de carbone (disposés en hexagones en nid d'abeilles) pour former une molécule covalente. Parce que chaque atome de carbone émet un électron, celui qui peut se déplacer librement, le graphite est donc conducteur.
Le graphite est l'un des minéraux les plus mous et ses utilisations incluent la fabrication de mines de crayon et de lubrifiants. Le carbone est un élément non métallique situé dans le groupe IVA du deuxième cycle du tableau périodique. Le graphite se forme à haute température.
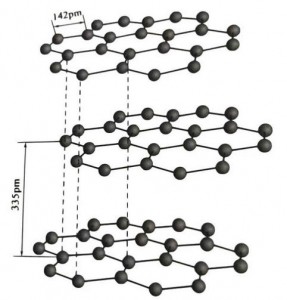
Le graphite est un minéral cristallin composé d'éléments carbonés et son réseau cristallin est une structure en couches hexagonale. La distance entre chaque couche de maille est de 3,35 A et l'espacement des atomes de carbone dans la même couche de maille est de 1,42 A. Il s'agit d'un système cristallin hexagonal avec un clivage en couches complet. La surface de clivage est principalement constituée de liaisons moléculaires, moins attractives pour les molécules, donc sa flottaison naturelle est très bonne.
Dans les cristaux de graphite, les atomes de carbone de la même couche forment une liaison covalente avec hybridation sp2, et chaque atome de carbone est connecté à trois autres atomes dans trois liaisons covalentes. Les six atomes de carbone forment un anneau à six continus dans le même plan, s'étendant dans une structure lamellaire, où la longueur de liaison de la liaison CC est de 142 pm, ce qui est exactement dans la plage de longueur de liaison du cristal atomique, donc pour la même couche , c'est un cristal atomique. Les atomes de carbone dans le même plan ont une orbite p qui se chevauche. Les électrons sont relativement libres, équivalents aux électrons libres dans les métaux, de sorte que le graphite peut conduire la chaleur et l'électricité, caractéristique des cristaux métalliques. Ainsi également classés comme cristaux métalliques.
La couche intermédiaire de cristal de graphite est séparée de 335 pm et la distance est grande. Elle est combinée avec la force de Van der Waals, c'est-à-dire que la couche appartient au cristal moléculaire. Cependant, comme la liaison des atomes de carbone dans la même couche plane est très forte et extrêmement difficile à détruire, le point de dissolution du graphite est également très élevé et ses propriétés chimiques sont stables.
Compte tenu de son mode de liaison particulier, ne pouvant être considéré comme un monocristal ou un polycristal, le graphite est désormais généralement considéré comme un cristal mixte.
Heure de publication : 31 juillet 2023