Le graphite, formule moléculaire : C, poids moléculaire : 12,01, est une forme d'élément carbone, chaque atome de carbone est relié par trois autres atomes de carbone (disposés en hexagones en nid d'abeille) pour former une molécule covalente.Parce que chaque atome de carbone émet un électron, ceux qui peuvent se déplacer librement, donc le graphite est un conducteur.
Le graphite est l'un des minéraux les plus doux et ses utilisations incluent la fabrication de mines de crayon et de lubrifiants.Le carbone est un élément non métallique situé dans le groupe IVA du deuxième cycle du tableau périodique.Le graphite se forme à haute température.
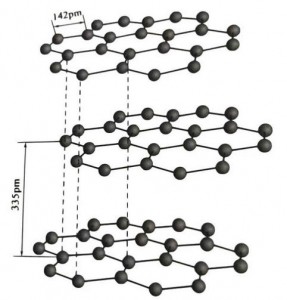
Le graphite est un minéral cristallin d'éléments carbonés et son réseau cristallin est une structure en couches hexagonale.La distance entre chaque couche de maille est de 3,35 A et l'espacement des atomes de carbone dans la même couche de maille est de 1,42 A.C'est un système cristallin hexagonal avec un clivage en couches complet.La surface de clivage est principalement constituée de liaisons moléculaires, moins attractives pour les molécules, donc son flotteur naturel est très bon.
Dans les cristaux de graphite, les atomes de carbone d'une même couche forment une liaison covalente avec hybridation sp2, et chaque atome de carbone est connecté à trois autres atomes dans trois liaisons covalentes.Les six atomes de carbone forment un anneau continu à six dans le même plan, s'étendant dans une structure lamellaire, où la longueur de liaison de la liaison CC est de 142 pm, ce qui est exactement dans la plage de longueur de liaison du cristal atomique, donc pour la même couche , c'est un cristal atomique.Les atomes de carbone dans le même plan ont une orbite p, qui se chevauchent.Les électrons sont relativement libres, équivalents aux électrons libres dans les métaux, de sorte que le graphite peut conduire la chaleur et l'électricité, ce qui est la caractéristique des cristaux métalliques.Ainsi également classés comme cristaux métalliques.
La couche intermédiaire de cristal de graphite est séparée de 335 pm et la distance est grande.Il est combiné avec la force de van der Waals, c'est-à-dire que la couche appartient au cristal moléculaire.Cependant, comme la liaison des atomes de carbone dans une même couche plane est très forte et extrêmement difficile à détruire, le point de dissolution du graphite est également très élevé et ses propriétés chimiques sont stables.
Compte tenu de son mode de liaison particulier, ne pouvant être considéré comme un monocristal ou un polycristal, le graphite est aujourd'hui généralement considéré comme un cristal mixte.
Heure de publication : 31 juillet 2023